iNature
1.大规模反刍动物基因组测序提供了对其进化和独特性状的见解

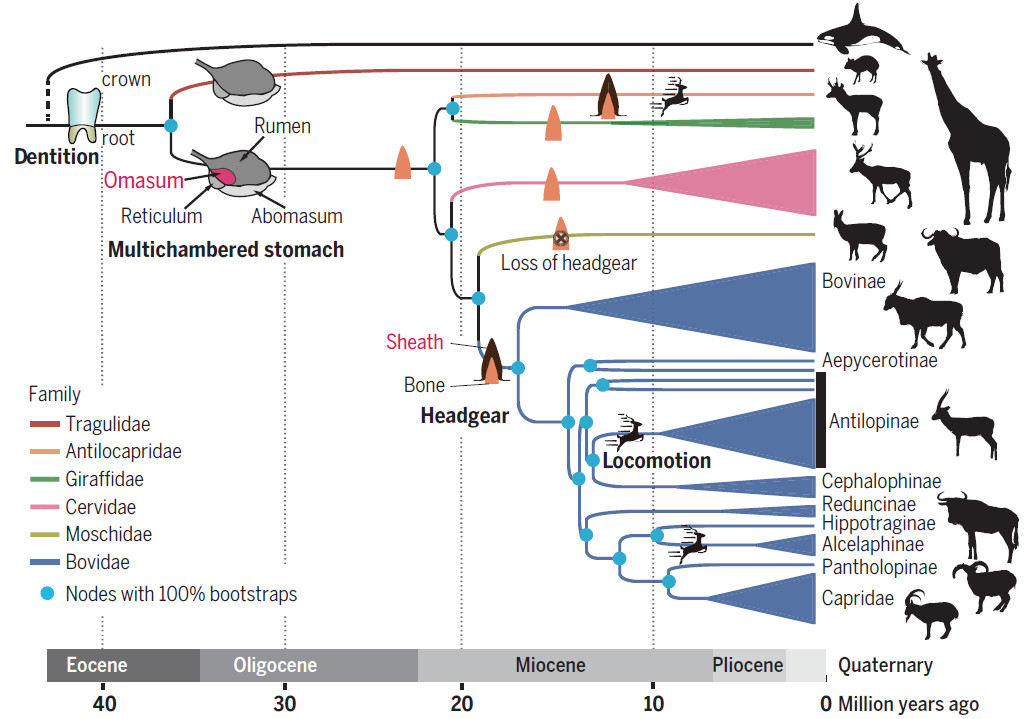
Ruminantia是一种重要的陆生食草动物,包括至少200种现存的物种,跨越六个科:Tragulidae,Antilocapridae,Giraffidae,Moschidae,Cervidae和Bovidae。这些家族中物种最丰富的是牛科动物,其中包括至少143种,包括重要的家畜(如牛,水牛,牦牛,绵羊和山羊)。反刍动物具有几个独特且特征性的解剖学标志,例如多腔胃和颅附件(头带)。获得反刍动物和卵子中的瘤胃(除了Tragulidae之外的所有反刍动物)都允许这些动物使用比其他食草哺乳动物更高效的植物材料,例如马科动物。这种效应被认为与这些动物在多样性,丰度和地理范围方面的进化成功有关。反刍动物也进化出极端的形态多样性,体重从<2 kg到> 1200 kg,以及各种不同的行为和生理特征。最终,反刍动物的这些适应性可能解释了这些动物在家畜中的显著丰富程度。
尽管它们具有生物学上的突出地位和对人类文明的价值,但关于反刍动物的知识还是很有限。例如,反刍动物的系统发育远未解决,甚至在家庭层面也存在不一致。此外,其许多特征性状的遗传基础仍然未知。
文章总结
为了填补在知识方面的空白,研究人员对44种反刍动物的基因组进行了从头组装,代表了跨越所有六个家族的36个属。结合五个先前发表的bovid基因组,两个已发表的cervid基因组,以及最近更新的化石信息,该研究构建了该组的时间校准系统发育树,分析了物种种群历史,并研究了这些物种基因组进化。该研究结果不仅为了解这一重要哺乳动物群体的起源和进化及其特殊性状提供了数据,而且还具有将反刍家畜基因组资源置于进化背景和保护反刍动物生物多样性的意义。
参考信息:
https://science.sciencemag.org/content/364/6446/eaav6202
2.北极鹿的生物适应性

驯鹿(Rangifer tarandus)自然分布在北极和亚北极地区。它们面临着严峻的寒冷和冬季有限的食物供应,以及一年中长时间的光明和黑暗等挑战,因此必须制定战略以解决这些环境障碍。例如,驯鹿没有表现出24小时的活动节律,并且有证据表明昼夜节律组织很弱甚至没有,表明它们的内部生物钟可以适应北极的极端光周期。这些动物也开发了一种特殊的脂肪代谢过程,通过外周血管收缩限制热量损失,并保持低静息代谢率。

入选为本期Science封面
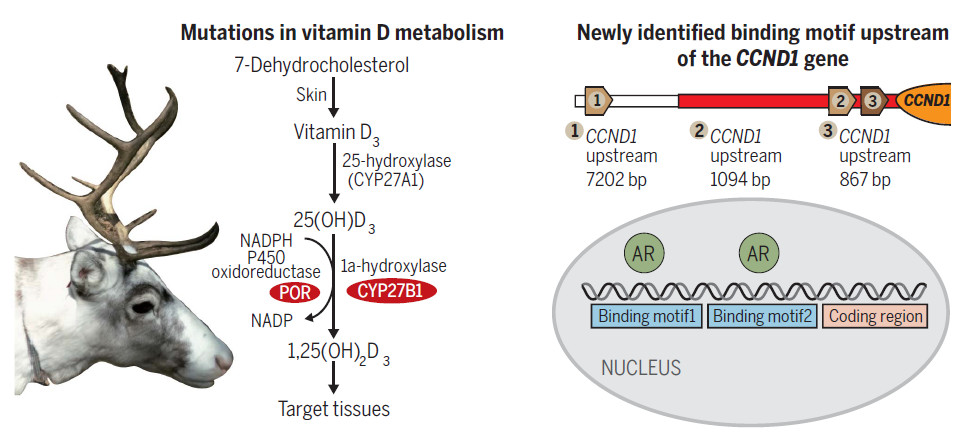
另一个挑战是,尽管必须应对低水平的太阳能,但驯鹿需要满足快速鹿茸生长的钙需求,因此暗示它们必须具有特别高的代谢维生素D的能力。此外,尽管考古证据表明人类已经在数千年发现了驯鹿,但是Tarandus是Cervidae家族中唯一完全驯化的物种。在这方面,过去几个世纪出现广泛的驯鹿饲养对于亚洲和欧洲北极高地的人类文明发展具有相当重要的意义。然而,目前对其潜在的遗传原因知之甚少。
独特的突变解释了驯鹿的生物适应性
该研究使用驯鹿,其他反刍动物物种和许多哺乳动物外群之间进行了比较基因组分析,以鉴定快速进化的基因。然后进一步重新测序了来自中国北方的三只家养驯鹿和来自北欧的三只野生驯鹿的基因组,以验证驯鹿特异性突变是固定在物种而不是个体多态性。该研究发现维生素D代谢途径中涉及的两个基因(CYP27B1和POR)在驯鹿中处于阳性选择状态。此外,功能实验验证了两种关键酶(CYP27B1和POR)比山羊和狍中的直系同源物具有更高的催化活性。另外,该研究还确定了在脂肪代谢中发挥作用的基因,包括APOB和FASN。有趣的是,该研究还发现驯鹿CCND1基因上游的突变赋予雄激素受体额外的功能性结合基序,因此可能导致雌性鹿茸生长。
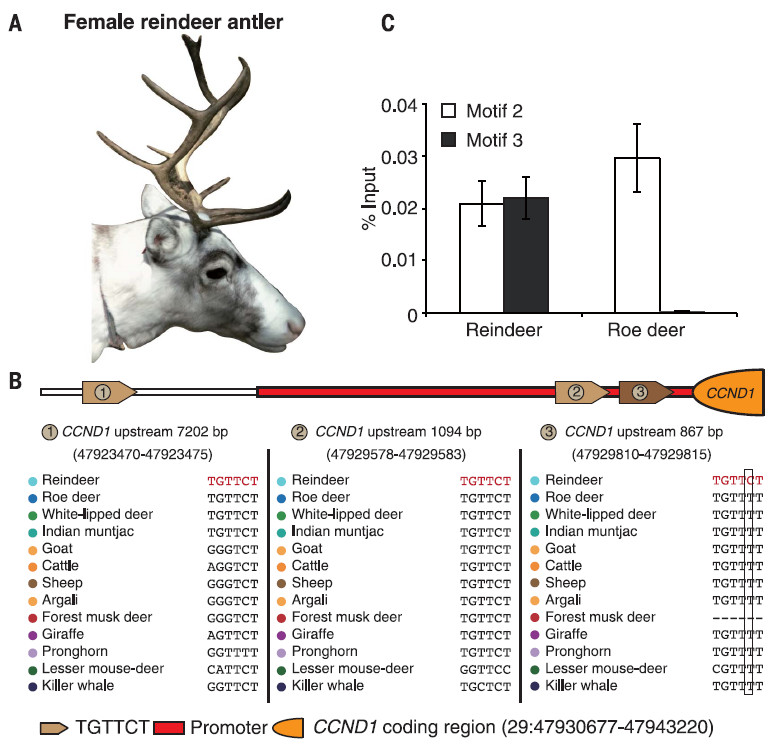
CCND1上游的雄激素受体亲和序列5'TGTTCT-3'
总而言之,该研究结果揭示了北极鹿的广泛特征的遗传基础,并为理解哺乳动物对北极的适应性策略提供了基础。比较基因组研究和功能分析鉴定了许多基因,这些基因具有与昼夜节律性心律失常,维生素D代谢,顺应性和鹿茸生长相关的功能,以及独特突变和/或正选择的基因。该结果可能提供与人类健康相关的见解,包括驯鹿中维生素D的遗传反应如何影响骨骼和脂肪代谢以及基因如何影响昼夜节律性心律失常。
参考信息:
https://science.sciencemag.org/content/364/6446/eaav6312
3.反刍动物头带的遗传基础和快速鹿角再生

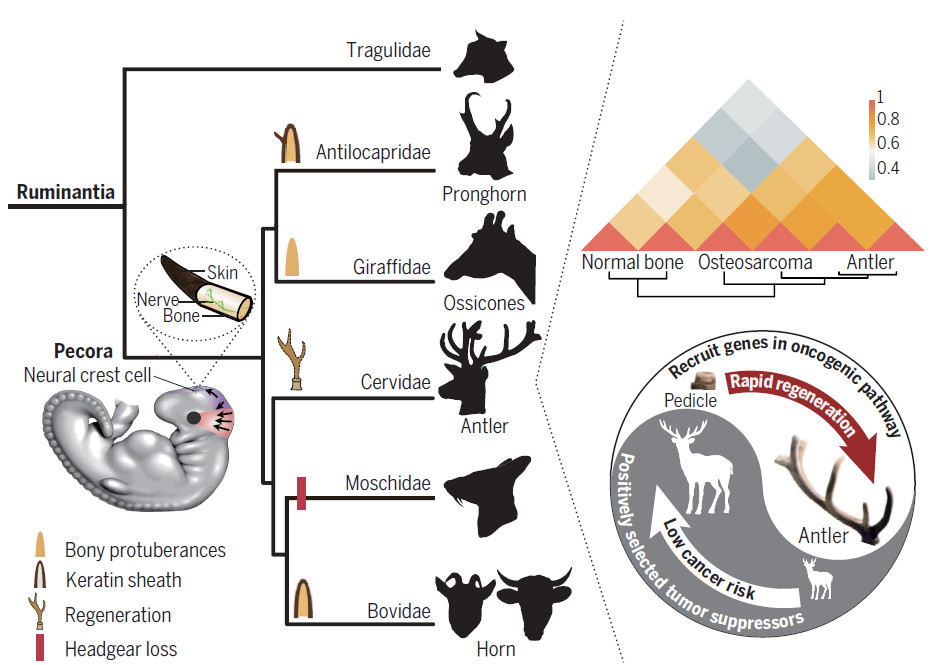
反刍动物是现存的唯一具有骨颅附属物的哺乳动物,统称为头带。 Osseous头饰专门用于pecorans(所有反刍动物,不包括Tragulidae),一组辐射约2330万至2080万年(Ma)。 pecoran组中的每个家族都表现出明显的头带形态。长颈科的ossicones由仅由皮肤和头发覆盖的骨质突起组成。 Antilocapridae的pronghorns由皮肤,头发和每年落叶叉状角鞘覆盖的骨头组成。牛科的角也有一个骨头核心,但被一个非坚硬的,非褶皱的角质鞘覆盖。鹿科的鹿角是完全落叶的,每年作为前额颅骨的骨骼生长而再生。

在Ruminantia和Cervidae中没有头带的物种的系统发育基因组
尽管存在这种变化,但所有这些类型的pecoran头带(包括已灭绝物种的头饰)都具有共同的特征,例如它们的额颅位置和被外膜覆盖的骨芯。Headgear的进化起源,特别是头带是否只进化过一次或多次,已经成为一个相当大的科学讨论问题。由于对反刍动物的家族级系统发育缺乏共识,解决这一问题已证明具有挑战性。
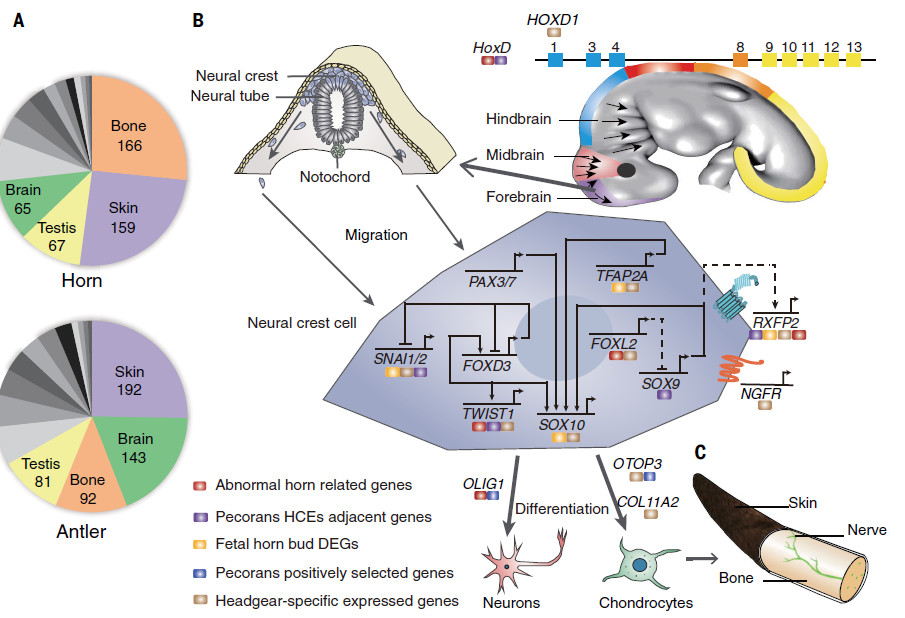
反刍动物头带的基因募集和细胞起源
对于该研究,从牛科动物和鹿科动物中获得了221个转录组,并对三个基因组进行了测序,这三个基因组代表了两个聚合缺乏头带的pecoran谱系。将数据与大量反刍动物基因组进行比较,检测出具有头带(PWH)的pecorans中的遗传变化。

在cervids中阳性选择的肿瘤抑制基因的实例
该研究发现角和鹿角中高度或特异性表达的基因最常在骨,皮肤,神经组织和睾丸中共表达。 PWH中正向选择的许多基因(例如,OLIG1,OTOP3),与高度保守的元件相关的PWH特异性基因(例如,HOXD基因簇,SNAI2,TWIST1,SOX9),以及在头带中高度或特异性表达的基因(RXFP2,SOX10) ,NGFR)参与神经功能。此外,在头带和睾丸中特异性表达的RXFP2在Moschidae和Hydropotinae的无头部谱系中会聚。鹿茸的表达谱与骨癌相比与正常骨组织表达谱更相关。在cervids中选择了许多原癌基因(FOS,REL,FAM83A)和肿瘤抑制基因,特别是几种辅因子基因(PML,NMT2和CD2AP)和调节基因(ELOVL6,S100A8,ISG15,CNOT3和CCDC69)。 )p53肿瘤抑制因子,提示这些适应性改变可能增强鹿的抗癌能力。
文章总结
总而言之,该研究从系统发育,基因表达谱等方面支持反刍动物头带的单一进化起源。 Pecoran头带可能与神经嵴干细胞具有共同的细胞来源,并且软骨和神经谱系的确定对于头带发育很重要。此外,肿瘤抑制因子和原癌基因的cervid特异性遗传变化暗示鹿茸组织的再生特性。该研究揭示了反刍动物头带的进化,发育和组织学起源以及鹿角再生的遗传机制。已鉴定的基因及其独特的突变为未来头带发育,哺乳动物器官再生和肿瘤发生的功能研究提供了指导。
参考信息:
https://science.sciencemag.org/content/364/6446/eaav6335
